為何要進行細胞治療應優先選擇到慈濟醫院
對於目前標準治療難以改善的腦中風、脊髓損傷、退化性膝關節炎等疾病,以及目前經標準治療無效的1~3期或4期癌症患者。近幾年,佛教慈濟醫療財團法人花蓮慈濟醫院醫療水準及醫療科技研發已經獲得國際間肯定,林欣榮院長團隊在幹細胞治療腦神經病變領域居全球領導地位。在本國正式公告特管辦法後,本院即將開始以幹細胞或免疫細胞等醫療技術,為您提供醫療服務。

花蓮慈院打造細胞治療中心 再生醫療迎曙光


本院神經再生醫療與免疫細胞治療兩大台柱 林欣榮院長與李啟誠主任
為何要進行細胞治療應優先選擇到慈濟醫院
對於目前標準治療難以改善的腦中風、脊髓損傷、退化性膝關節炎等疾病,以及目前經標準治療無效的1~3期或4期癌症患者。近幾年,佛教慈濟醫療財團法人花蓮慈濟醫院醫療水準及醫療科技研發已經獲得國際間肯定,林欣榮院長團隊在幹細胞治療腦神經病變領域居全球領導地位。在本國正式公告特管辦法後,本院即將開始以幹細胞或免疫細胞等醫療技術,為您提供醫療服務。

花蓮慈院打造細胞治療中心 再生醫療迎曙光


本院神經再生醫療與免疫細胞治療兩大台柱 林欣榮院長與李啟誠主任
花蓮慈濟幹細胞與精準醫療研發中心
| 適應症 | 細胞治療項目 |
| 實體癌第四期 | 自體免疫細胞治療-Gamma-delta T、T-CIK、NK、DC |
| 第一至第三期實體癌經標準治療無效 | 自體免疫細胞治療-CIK、DC |
| 脊髓損傷 | 自體骨髓幹細胞治療 |
| 退化性關節炎及膝關節軟骨缺損 | |
| 退化性關節炎及膝關節軟骨缺損 | 自體脂肪幹細胞治療 |
| 皮下及軟組織缺損 | |
| 慢性或滿六週未癒合之困難傷口 |
| 藥品名 | 適應症 | 藥證字號 |
|
祈萊亞靜脈輸注用懸浮液 (Kymriah,簡稱CAR-T) |
經過基因修飾的自體免疫細胞療法,適用於治療:
|
衛部菌疫輸字第001176號 |
何謂細胞治療
細胞治療屬於再生醫學的範疇。而再生醫學用作醫療技術的通用術語,泛指使用細胞和組織移植,以再生因疾病或損傷而喪失的功能。 再生醫學的範圍非常廣泛,並且已廣泛用於器官移植,骨髓移植,其實日常的捐血輸血就屬於一種再生醫療,存在於你我日常生活所常見處。
本院開設細胞治療門診的法源依據
目前特管辦法開放項目列表
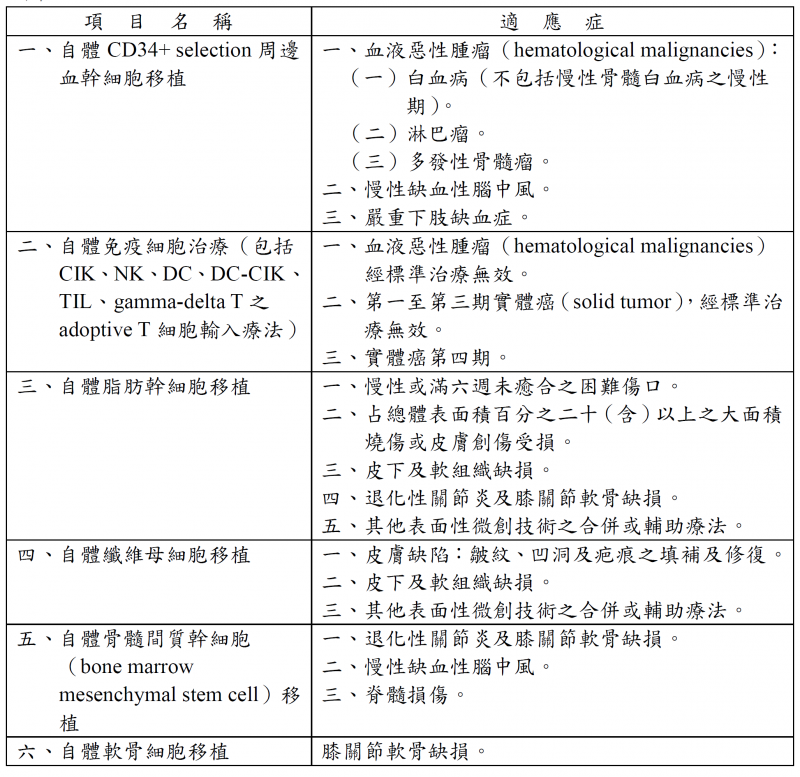
衛福部公告「特管辦法修正草案」開放細胞治療及微菌叢植入治療
衛生福利部於於107年9月公告「特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法修正草案」(以下稱特管辦法),未來,醫療機構可依該辦法規定擬具實施計畫,經主管機關核准登記後,即可對符合適應症的病患施行細胞治療及微菌叢植入治療。
衛福部表示,依現行規定,細胞治療須依醫療法規定進行人體試驗,惟近年該項醫療技術發展迅速,鄰近國家如日、韓等國,均積極投入,國內亦不乏癌症患者自費前往日本等國尋求治療,為使細胞治療技術可早日應用於有需要之國人,衛福部經多方研議後,修正特管辦法,將國外已施行、風險性低,或已經於國內實施人體試驗累積達一定個案數,安全性可確定、成效可預期之細胞治療項目,開放運用於符合適應症之臨床治療個案(如附件),但為確保其施行品質、保障病患權益,實施細胞治療之醫療機構須遵循以下規定:
1.擬訂計畫書向中央主管機關申請核准,並經直轄市、縣(市)主管機關登記。計畫書並應載明施行醫師、實施項目、費用及收費方式、效果追蹤、同意書範本與不良反應救濟措施等。
2.涉及細胞培養或儲存者,應備有或委託符合人體細胞組織優良操作(GTP)相關規範之操作實驗室,並通過主管機關查核。
3.除病歷外,應另製作紀錄並保存10年,如接受其細胞治療之病人發生嚴重不良反應,應於7日內通報主管機關。
4.每年向中央主管機關提出年度施行結果報告,若有影響病人權益與安全、不良事件發生數或嚴重度明顯異常者,中央主管機關得終止其施行。
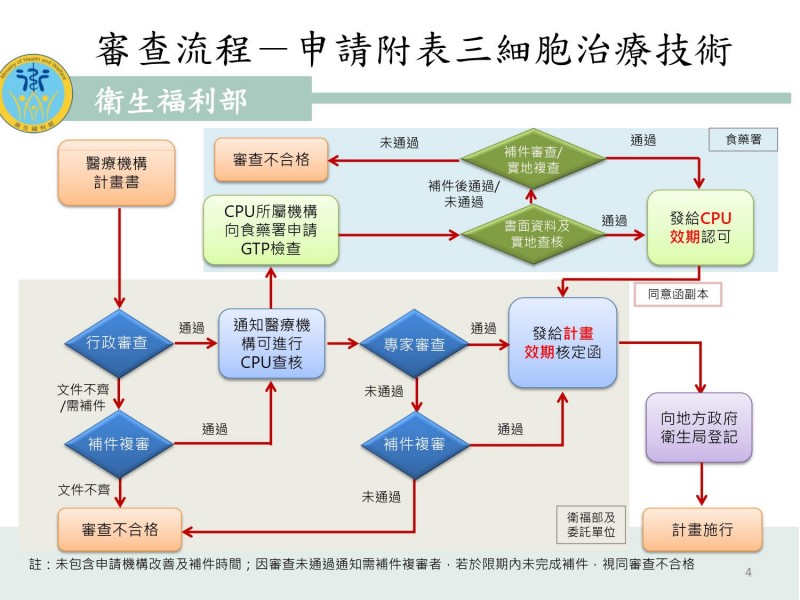
衛福部公告的細胞治療計畫審查流程