臨床試驗中心
Clinical Trial Center

最新公告
| No | 項 目 標 題 | 公告日期 |
| 1 | 自即日起,本院制式合約「委託佛教慈濟醫療財團法人花蓮慈濟醫院實施臨床試驗協議書」請使用新版(第5版1140515),請至「相關文件表單」下載。 | 2025.05.30 |
| 2 | 「研究計畫經費繳款單」注意事項,補充說明「PI團隊自行執行計畫」的繳費方式,請至「相關文件表單」下載新版檔案。 | 2025.02.20 |
| 3 | 若是由PI團隊自行執行計畫(非委託臨床試驗中心SC協助執行),相關業務請聯絡負責案件之研究護理師/研究助理。 | 2025.02.05 |
| 4 | 自2025年1月1日起,合約審查費調整「套用廠商制式合約」及「修改合約」為5,250元(含稅)/案,繳費單改用新版,請至「相關文件表單」下載。 | 2024.12.31 |
| 5 | 自即日起,「廠商委託研究計畫經費編列表暨部門配合表」及「廠商委託計畫經費結算表」改用新版,請至「相關文件表單」下載。 | 2024.12.31 |
| 6 | 自2024年12月1日起,「藥品管理費」請依臨床試驗藥局規定付款,與其他「研究計畫經費」計畫款等皆分開二筆付款,請勿合併款項。結算時,亦與「研究計畫經費」分開結算。相關表單「廠商委託研究計畫經費編列表暨部門配合表」、「廠商委託計畫經費變更申請表」及「廠商委託計畫經費結算表」改用新版。 | 2024.11.26 |
| 7 | 自即日起,因應合約審查之不同情形,新增「其他」類,依實際狀況收費,「合約審查相關費用繳費單」改用新版,請至「相關文件表單」下載。 | 2024.10.08 |
| 8 | 廠商人員(CRA)到院監測(MV)請於「4週前」向負責案件的研究護理師/研究助理提出。 | 2024.06.19 |
| 9 | 自即日起,「廠商委託計畫經費結算表」改用新版,請至「相關文件表單」下載。 | 2023.12.27 |
| 10 | 自即日起,「合約審查相關費用繳費單」改用新版,請至「相關文件表單」下載。 | 2023.07.20 |
| 11 | 自2023年7月1日起,本院制式合約「委託佛教慈濟醫療財團法人花蓮慈濟醫院實施臨床試驗協議書」請使用新版(第4版1120615),請至「相關文件表單」下載。 | 2023.06.16 |
| 12 | 自即日起,調整合約及經費變更需備表單,並採用新版「合約審查相關費用繳費單」,請至「相關文件表單」下載。 | 2023.04.25 |
| 13 | 臨床試驗中心接受廠商委託稽查核之相關收費,請與負責SC或臨床試驗中心窗口聯繫。 | 2023.01.02 |
| 14 | 自即日起,因應藥品管理費加收10%院方管理費,新案採用新版「廠商委託研究計畫經費編列表暨部門配合表」。 | 2022.01.04 |
| 15 | 自即日起,因應討論合約條文召開視訊會議之需求,新增視訊會議出席費,並採用新版繳費單。 | 2021.07.26 |
| 16 | 自即日起,調整新案申請需備資料。 | 2021.04.26 |
| 17 | 2020年1月1日起,因應財政部規定,廠商委託計畫之補助款將加收5%營業稅並開立發票,如有相關問題請洽本院財務室。 | 2020.01.01 |
前言
臨床試驗是要瞭解並證明新藥物或新治療方式的療效和安全性而在人體執行的研究,研究的目的是為了找到更好的治療疾病的方式讓每一位病患皆得到更好的治療成果
醫學及科學的進步,都是新點子及新方法經由研究發展而來的結果。這些新的治療在應用於病人之前,必須先在實驗室或動物小心地進行研究,找出成功機率最高的方法。但是實驗室的研究或動物研究並不能確保新療法在病人身上的反應,因為任何療法都可能有其療效、也可能有風險,甚至可能還有一些未知的反應或變化。所以新治療在被廣泛應用於臨床的常規治療之前,必須先按部就班地通過嚴謹的人體臨床試驗,用科學的方式證實其安全性及有效性,以便能找出更新、更好的治療來幫助每一位病患。參加臨床試驗的病患通常是最先使用新療法的人,因此也最有機會較早從新治療中獲益,這尤其對嚴重或是少見疾病的患者有很大的幫助。另一方面,所有參加臨床試驗的病患在試驗期間的一切醫療措施,都會受到事前的研究審查,後續執行也會在研究組織中仔細地監測,所以參加臨床試驗的病患往往可以得到更高品質的醫療照顧。

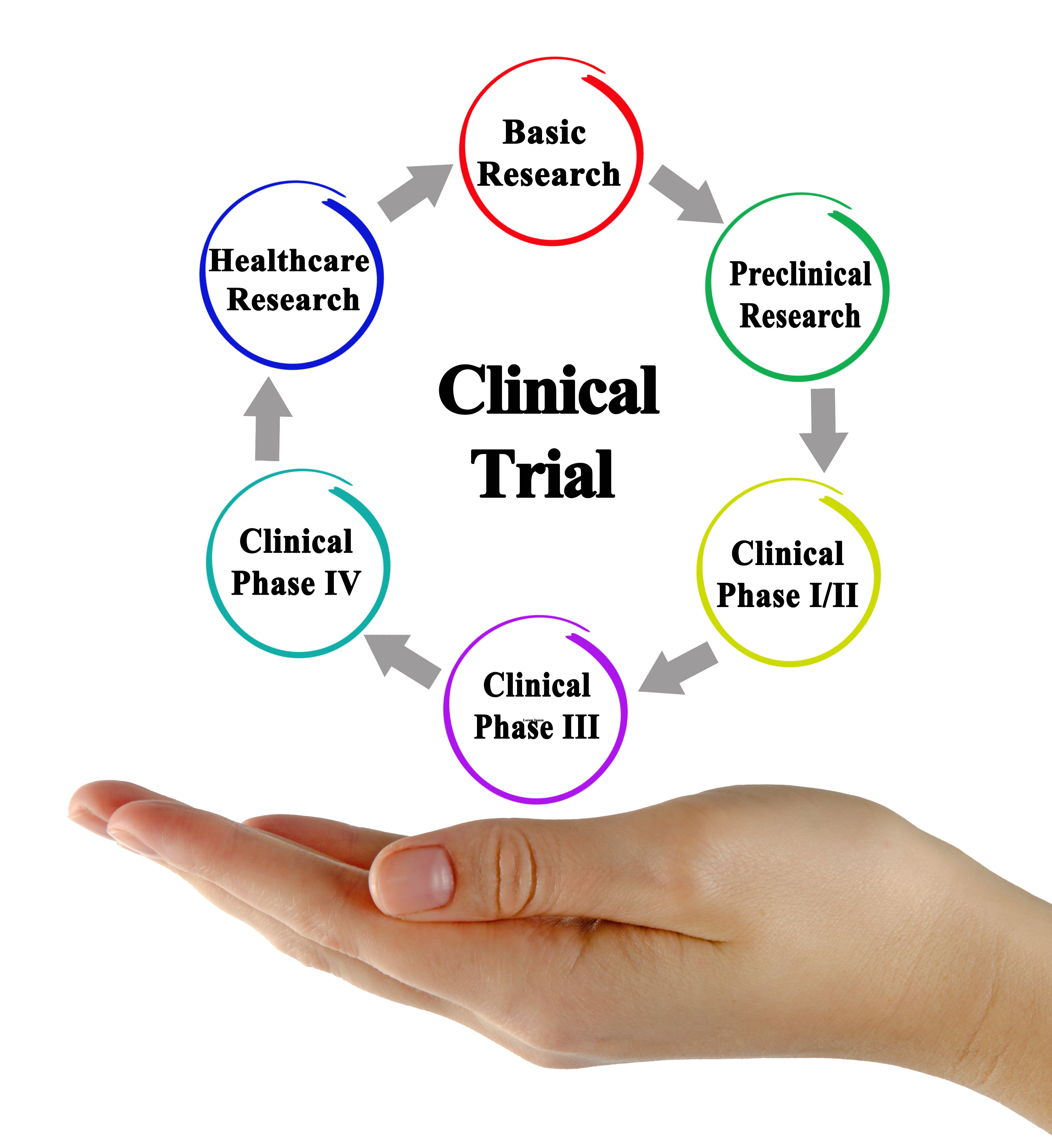
研究服務內容
- 為廠商轉介適合之臨床試驗主持人/協同主持人
- 計畫經費預估(試驗案已啟動送審相關資料收集,但尚未簽署臨床試驗合約前即撒案,仍須繳納試驗起始費)
- 協助臨床試驗合約審查與加速簽署合約書進度
- 研究護理師人力支援
- 協調院內各單位配合研究案進行
- 協助臨床試驗執行與配合稽核
相關文件表單下載
|
項目 |
文件 / 表單名稱 |
更新日期 |
|
新案申請 |
2025.05.30 |
|
|
廠商委託研究計畫經費編列表暨部門配合表 (新案申請須檢附) |
2024.12.31 |
|
|
花蓮慈濟醫院或廠商制式合約編修表 (本院"制式"或廠商"制式"合約編修申請須檢附) |
2021.04.26 |
|
|
|
臨床研究人員識別證與電子病歷權限申請表 |
停止辦理 |
|
依負責單位公告為主 |
||
|
廠商委託計畫經費變更申請表 (試驗期間經費變更請填寫此表單) |
2024.11.26 |
|
|
廠商委託臨床試驗合約編修表 (試驗期間合約變更請填寫此表單,若經費有同步變更請一併檢附"廠商委託計畫經費變更申請表") |
2023.04.25 |
|
|
收費相關 |
2024.12.31 |
|
|
2025.02.20 |
||
|
臨床試驗藥品管理費繳費單(藥品管理費、非室溫藥品儲存費繳納後始接受相關訓練及收受並管理試驗用藥) |
依負責單位公告為主 |
|
|
廠商委託計畫經費結算表(試驗結束經費退款需檢附) |
2024.12.31 |
|
|
其他 |
依負責單位公告為主 |
|
|
依負責單位公告為主 |
||
|
Invoice(範例參考) |
2022.05.27 |
環境設備介紹






臨床試驗暨合約相關業務諮詢
聯絡電話:03-8561825轉17602(吳研究護理師)
聯絡信箱:mfwu@tzuchi.com.tw
聯絡地址:97002花蓮市中央路三段707號協力六樓602室 (臨床試驗中心)
意見信箱:HUALIEN-CTC@tzuchi.com.tw
靜思語
水滴雖微,漸盈大氣


