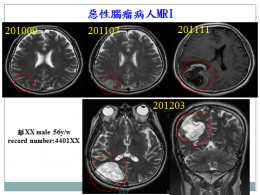
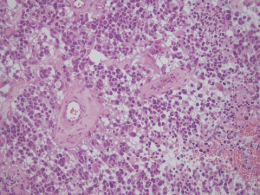
惡性腫瘤持續高居國人十大死因之首,根據美國癌症協會( American Cancer Society, ACS )以及美國腦瘤病例登錄中心( Central brain tumor registry, CBTRUS ) 的統計報告顯示,每年估計約有兩萬筆的腦瘤新病人被確診,臺灣每年約有四百名惡性膠質腦瘤新病例。多型性神經膠母細胞瘤(Glioblastoma multiformis, GBM) 是相當惡性的腦部腫瘤,腫瘤一個月內最快可長大十六倍,是惡化快速的原發性腦瘤,切除後的復發率也非常高,一般確診為四級GBM的病人,平均存活時間只有十二至十八個月。惡性腦瘤擴散程度迅速又難以根除,一旦確診後,通常已是晚期,病人平均存活期往往只有一年左右,五年存活率更只有百分之三點四。醫學上現有治療惡性腦瘤的方式,包含手術治療、放射線治療及化學治療,效果非常有限。
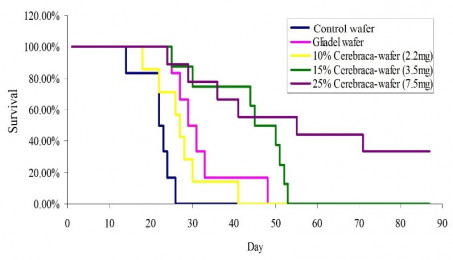
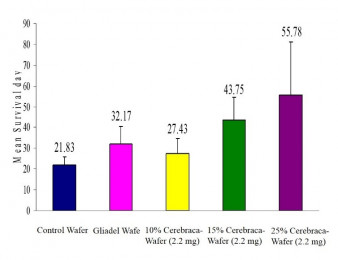
Cerebraca® wafer之安全性與有效性已經過多種動物模式驗證。例如,以大鼠為實驗對象,將Cerebraca® wafer將藥物釋放至腦瘤區,動物平均存活時間比不接受治療組別延長2.5倍。與其他藥物不同,Cerebraca® wafer的主成分BP是一個多標靶的小分子藥物,相關論文十九篇分別發表在Journal of Neurochemistry, Neuro-Oncology、Biochemical pharmacology及Clinical Cancer Research, Oncogene等著名科學期刊;並已取得臺灣、中國大陸、美國、日本及歐盟等多國專利。
長弘生技是一間小而美的新藥創新研發公司,成立至今先後獲得生技新藥認證、經濟部科專計畫以及A+淬鍊計畫之肯定,團隊亦獲得國家新創獎、科技部傑出技轉貢獻獎之殊榮。
長弘生技公司已完成Cerebraca® wafer PIC/s GMP生產,於二○一六年八月起,陸續通過美國藥物食品管理局(FDA)及台灣衛福部(TFDA) 之新藥臨床試驗許可(Investigating New Drug, IND)。花蓮慈濟醫院以及三軍總醫院之人體試驗委員會也核准執行臨床試驗。長弘生技周姵妏董事長表示,這項台灣本土開發、振奮醫藥界的癌症小分子標靶新藥,已使臺灣新藥研發邁入新里程,將於今年10/17/2017 開始I/IIa期臨床實驗,渴望能及早嘉惠患者。
附註:參考資料
圖1. 惡性腦瘤擴散程度迅速又難以根除,且手術後容易復發。
圖2. 標靶新藥物Cerebraca ® wafer
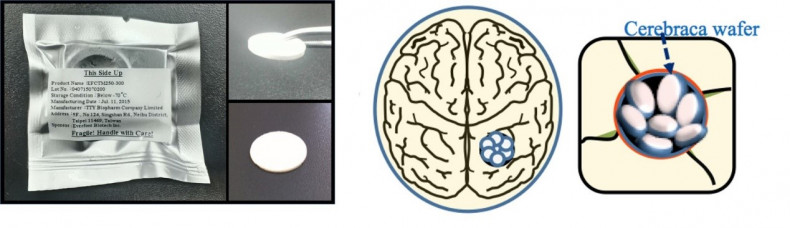
圖3. 標靶藥物暨投遞裝置Cerebraca ® wafer在動物模式內可延長2.55 倍存活天數(多延長34天)